AB Science : nouveau brevet au Canada pour le Masitinib dans le traitement de la SLA
Ce nouveau brevet canadien assure une protection solide du masitinib d'AB Science SA dans le traitement de la SLA jusqu'en 2037...
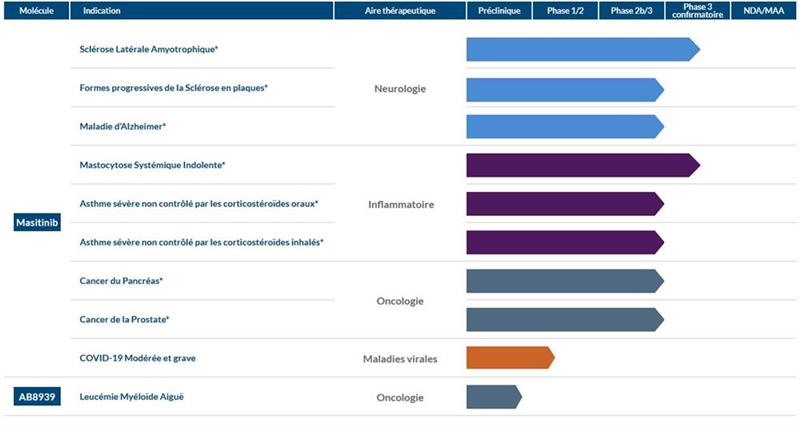
L'office des brevets du Canada a émis un avis d'acceptation pour un brevet relatif aux méthodes de traitement de la sclérose latérale amyotrophique (SLA) avec sa molécule phare, le masitinib (CA 3018635).
Ce nouveau brevet canadien assure une protection solide du masitinib d'AB Science SA dans le traitement de la SLA jusqu'en 2037, et complète la position de la société en matière de propriété intellectuelle dans la SLA dans toutes les zones géographiques où le masitinib pourrait être commercialisé, notamment l'Europe, les Etats-Unis, la Chine, la Corée du Sud, le Japon, Singapour, Hong Kong, Israël, l'Australie, l'Eurasie, le Mexique, la Nouvelle-Zélande et l'Afrique du Sud.
Un avis d'acceptation est délivré après qu'un examinateur a déterminé que la demande de brevet satisfait à toutes les conditions de brevetabilité. Outre la protection du brevet, le masitinib peut également bénéficier d'une protection réglementaire des données au Canada, ce qui empêche la concurrence des génériques pendant une période de 8 ans à compter de l'autorisation initiale de mise sur le marché.
AB Science rappelle avoir reçu l'autorisation de Health Canada pour soumettre une demande de mise sur le marché du masitinib dans le traitement de la SLA, sous le statut NOC/c (Notice of Compliance with Conditions). L'autorisation de mise sur le marché sous le statut NOC/c permet à Health Canada d'offrir un accès plus précoce au marché à des médicaments susceptibles de sauver des vies. Le statut NOC/c est accordé à des produits éligibles qui ont démontré une efficacité clinique prometteuse lors d'essais cliniques. Le 9 mai 2023, AB Science a annoncé que Health Canada avait repris la revue du dossier d'enregistrement du masitinib dans le traitement de la SLA. Sous le statut NOC/c, Health Canada dispose de 200 jours calendaires au maximum pour examiner le dossier.
Le masitinib a également reçu la désignation de médicament orphelin pour la SLA à la fois de l'Agence Européenne du Médicament (EMA) et de la Food and Drug Administration (FDA) américaine. Cette désignation confère respectivement 10 et 7 ans d'exclusivité commerciale en Europe et aux Etats-Unis à partir de l'enregistrement du produit. Actuellement, 3.000 Canadiens vivent avec la SLA. Chaque année, environ 1.000 Canadiens meurent de la SLA. Environ 1.000 nouveaux cas de SLA sont diagnostiqués au Canada chaque année.
Les informations et conseils rédigés par la rédaction de Boursier.com sont réalisés à partir des meilleures sources, même si la société Boursier.com ne peut en garantir l'exhaustivité ni la fiabilité. Ces contenus n'ont aucune valeur contractuelle et ne constituent en aucun cas une offre de vente ou une sollicitation d'achat de valeurs mobilières ou d'instruments financiers. La responsabilité de la société Boursier.com et/ou de ses dirigeants et salariés ne saurait être engagée en cas d'erreur, d'omission ou d'investissement inopportun.
- 0 vote
- 0 vote
- 0 vote
- 0 vote
- 0 vote